Propósito:
Profundizará en la comprensión de los conceptos básicos de la química, mediante el estudio de reacciones del oxígeno con elementos metálicos y no metálicos, para comprender algunos cambios químicos que suceden a nuestro alrededor.
Explicará la clasificación de los elementos en metales y no metales y la de sus óxidos, por medio de la construcción de modelos operativos de átomos y moléculas, para comprender el comportamiento químico de los elementos.
Oxigeno sobre los elementos
Reacciones de oxigeno
El oxígeno es el elemento más abundante en el planeta tierra, constituye aproximadamente el 50% en masa de la corteza terrestre y forma el 21% en volumen de la atmósfera; es componente activo del aire, se encuentra presente en el agua y como óxidos con otros elementos. Reacciona tanto con metales como con no metales y, entre los no metales es el segundo en re actividad química, después del flúor.
Existen do alotropos del oxígeno, el más común es la molécula diatómica O2, el otro es el ozono que es una molécula triatómica, O3.
Todo fenómeno químico puede ser representado a través de una ecuación química, que nos muestra los cambios que se llevan a cabo, así podemos describir las variaciones que se realizan cuando se oxidan los elementos metálicos y no metálicos en presencia de oxígeno y con el auxilio de la energía calorífica. A continuación se muestra un ejemplo de cada uno de estos.
No metales:
Las variaciones que se realizan cuando se oxidan los elementos no metálicos en presencia de oxígeno y con el auxilio de la energía calorífica. Se puede tomar como ejemplo el carbono, cuando éste es sometido a la reacción de oxidación en la flama, se lleva a cabo su combustión y se desprende un gas llamado monóxido de carbono, en el caso de su valencia de menor valor; en la otra posibilidad cuando la valencia de intercambio del carbono es la mayor, forma el dióxido de carbono. En ambas reacciones hay desprendimiento de energía, el producto de estas reacciones son óxidos no metálicos.
Metales:
Un ejemplo de las reacciones del oxígeno con un metal, es la que ocurre con el magnesio al someterlo a la reacción de oxidación en una flama, pues desprende una intensa luz blanca y se convierte en un sólido blanco muy frágil; el producto de esta reacción es un óxido metálico llamado oxido de magnesio.
Ejercicio 1
Formación de óxidos
Reacciones de óxidos con agua
Después de la formación de los óxidos correspondientes tanto metálicos como no metálicos, es factible combinarlos con agua para formar nuevos compuestos. En el caso de los óxidos metálicos cuando interactúan con agua forman hidróxidos.
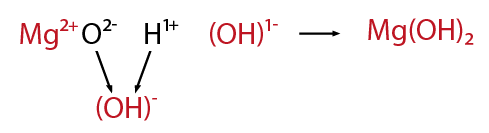
El óxido de magnesio en presencia de agua forma el hidróxido de magnesio.
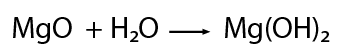
Los óxidos no metálicos en presencia de agua forman ácidos del tipo oxíacido
Por ejemplo en el dióxido de carbono o anhídrido carbónico al reaccionar con agua, produce una molécula de ácido carbónico.

Reglas de Nomenclatura
La nomenclatura química es un conjunto de reglas que se aplican para nombrar y representar con símbolos y fórmulas a los elementos y compuestos químicos. Actualmente se aceptan tres sistemas de nomenclatura donde se agrupan y nombran a los compuestos inorgánicos:
- Sistema de nomenclatura estequimétrico ó sistemático de la Unión Internacional de Química Pura y Aplicada, (IUPAC).
- Sistema de nomenclatura funcional, clásico ó tradicional.
- Sistema de nomenclatura Stock.
Óxidos metálicos
Resultan de la combinación del oxígeno con metales y al reaccionar con el agua producen bases.
Nomenclatura Stock
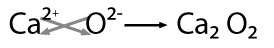
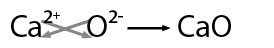
Nomenclatura clásica ó tradicional

Nomenclatura IUPAC

Nomenclatura Stock
Nomenclatura clásica ó tradicional


Nomenclatura IUPAC
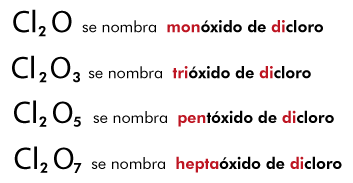


Se nombra con la palabra genérica óxido seguido de la preposición de enseguida el nombre del metal con el que se combinó, por ejemplo: oxido de calcio
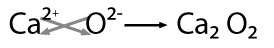
En este ejemplo hay posibilidad de obtener el mínimo común divisor entre los valores por lo que se obtiene: CaO -óxido de calcio-.
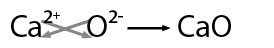
Cuando el metal presenta más de una valencia se nombran con la palabra genérica óxido seguida de la preposición de y después el nombre del metal, escribiendo entre paréntesis con número romano el valor de la valencia, por ejemplo:

Estos mismos compuestos se pueden nombrar con la palabra genérica óxido seguida del nombre del metal con el sufijo oso para el valor menor de la valencia y con el sufijo ico cuando el valor de su valencia es mayor, por ejemplo:

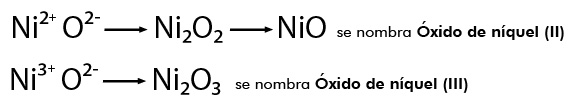
La IUPAC determina que estos compuestos se nombran a partir de la cantidad de elementos que los constituyen, por ejemplo:
NiO se nombra Monóxido de níquel y el Ni2O3 Trióxido de diníquel
Óxidos ácidos
Son combinaciones del oxígeno con un no metal y al reaccionar con agua producen ácidos del tipo oxiácido.

Se nombra con la palabra óxido seguida de la preposición de, a continuación el nombre del no metal expresando con número romano el valor de la valencia con la que interactuó con el oxígeno, por ejemplo:

Este mismo tipo de compuestos, también se pueden nombrar con la palabra genérica anhídrido seguida del nombre del no metal con el sufijo oso para el valor de la menor valencia e ico para el valor de la mayor valencia, por ejemplo:

Cuando el no metal presenta más de dos valencias como es el caso del cloro se conservan los sufijos de la regla anterior y se utilizan además: el prefijo hipo proveniente del griego "hypo" que significa inferior o debajo, y el prefijo hiper o per del griego "hyper" que significa mayor o superior, por ejemplo:

Este tipo de compuestos se nombran a partir de la cantidad de elementos que constituyan a su representación simbólica, empleando las raíces griegas de los números correspondientes, por ejemplo:
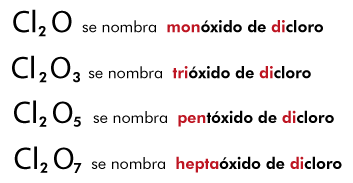
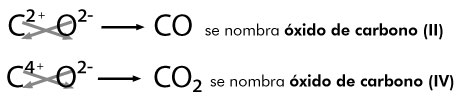
Dependiendo del número de valencias que presente el no metal, por ejemplo el carbono tiene dos valencias positivas 2+ y 4+, cuando actúa con el número de valencia 2+ al combinarse con el oxígeno 2-, se forma el monóxido de carbono, como se aprecia en la siguiente representación:

Cuando la combinación se lleva a cabo con la valencia 4+, resulta:

Hidróxido
Una de las principales aplicaciones de las bases o hidróxidos es en la fabricación de los jabones que usamos a diario en casa.
¿Cómo se forman y nombran los hidróxidos?
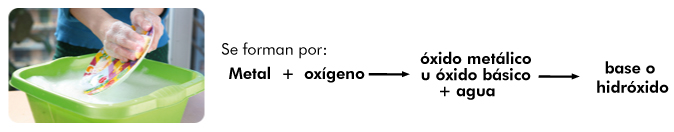
Cuando ya se tiene un óxido metálico, al combinarse con agua forma un hidróxido, también conocido como base, por ejemplo:
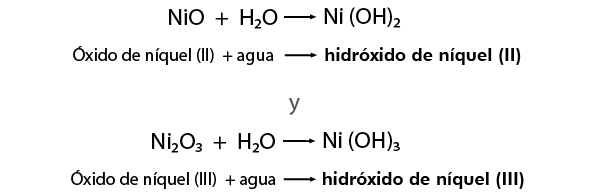
Se conserva la misma nomenclatura para nombrar a los compuestos derivados de los óxidos metálicos formando los hidróxidos correspondientes y también se conservan los sufijos "oso” para el valor menor de la valencia e "ico” para el valor mayor, por ejemplo:

Se conserva la misma nomenclatura, es decir, considerando la cantidad de elementos que constituyen el compuesto, por ejemplo:

Para aprender a escribir los modelos o las fórmulas de los hidróxidos con facilidad, puedes acudir a un recurso didáctico sencillo: combinar directamente el metal en forma de ion positivo con el radical hidroxilo con valencia 1- (OH)1-, como se muestra a continuación:
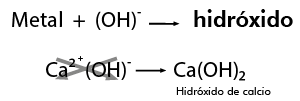
Ácidos
Cuando se tiene un óxido no metálico, al combinarse con agua forma un ácido de tipo oxiácido, se llaman oxiácidos porque en su composición está presente el oxígeno y la calidad ácida será determinada por la presencia del hidrógeno.
Estos tipos de compuestos son los que producen la lluvia ácida ya que son productos de desecho de la industria y de vehículos de combustión interna (automotores), debido a que se combinan con la humedad y agua del ambiente.
Estos tipos de compuestos son los que producen la lluvia ácida ya que son productos de desecho de la industria y de vehículos de combustión interna (automotores), debido a que se combinan con la humedad y agua del ambiente.
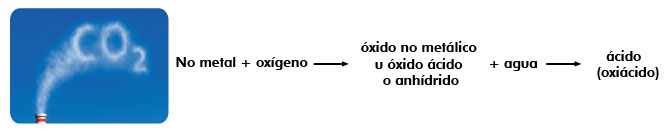
Se nombra al no metal con el sufijo ato, seguida del valor de la valencia del no metal y por último se agrega de Hidrógeno.
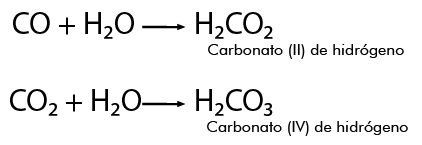
Si observas, cuando los óxidos no metálicos se combinan con agua por síntesis o adición forman su ácido correspondiente, derivando su nombre del anhídrido del cual provenían, se pierde la palabra anhídrido, se cambia por ácido y conserva el nombre de anhidrico originario.
Por ejemplo, para formar los ácidos correspondientes del carbono, se parte de su óxido o anhídrido en presencia de agua, reaccionan y se produce:
Por ejemplo, para formar los ácidos correspondientes del carbono, se parte de su óxido o anhídrido en presencia de agua, reaccionan y se produce:

Se conserva la misma nomenclatura, es decir, considerando la cantidad de elementos que constituyen el compuesto, por ejemplo:

Hidrácido
Este tipo de compuestos se forman con la combinación de un hidrógeno (H+) como ión positivo y un no metal (NM-) como ión negativo.

Se nombran con el nombre del no metal con sufijo uro seguida de la preposición de y finalmente la palabra hidrógeno, en estado natural. Por ejemplo:

En este caso convergen la nomenclatura clásica o tradicional y la de IUPAC, en éstas se nombran con la palabra genérica ácido seguida del nombre del no metal con el que se combinó y con el sufijo hidrico,en disolución acuosa, por ejemplo:
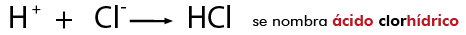
Nota:
EL EJERCICIO 3 CORRESPONDIENTE A NOMENCLATURA TRAE CIERTOS ERRORES, YA QUE NO TE DEJA RESPONDER EN TODOS LOS RECUADROS ADEMAS DE QUE LAS RESPUESTAS VIENEN REPETIDAS POR LO QUE OCASIONA QUE EL EJERCICIO SEA IMPOSIBLE DE CONTESTARLO COMPLETAMENTE.
Balanceo
El balanceo consiste en igualar el número de átomos de cada elemento tanto en los reactivos como en los productos, y sirve para verificar la Ley de la Conservación de la Materia (La materia no se crea ni se destruye solo se transforma).
Para escribir y balancear una ecuación química de manera correcta, es necesario tener presente las siguientes recomendaciones:
- Revisar que la ecuación química este completa y correctamente escrita.
- Observar si se encuentra balanceada.
- Balancear primero los metales, los no metales y al final el oxígeno y el hidrógeno presentes en la ecuación química.
- Escribir los números requeridos como coeficiente al inicio de cada compuesto.
- Contar el número de átomos multiplicando el coeficiente con los respectivos subíndices de las fórmulas y sumar los átomos que estén de un mismo lado de la ecuación.
- Verificar el balanceo final y reajustar si es necesario.
Balanceo un fenómeno de neutralización
Una reacción química de fenómeno de neutralización es la reacción de un acido y una base para formar sal y agua.
Para el balanceo de una ecuación de este tipo es necesario seguir los siguientes pasos:
- Observar que la ecuación química esté completa y bien escrita.
- Contar el número de elementos existentes en dicha ecuación del lado de los reactivos y después los correspondientes a los productos, empezando por: metales, no metales, dejando para el final al oxígeno e hidrógeno.
Ejercicio 4
Nomenclatura y balanceo de ecuaciones químicas
Actividad final
Ejercicios:
Memorama de Nomenclaturas y ecuaciones
comentario de la primera parte:
En lo general todos los temas se explican de una manera clara y son fáciles de comprender ya que se manejan atraves de una explicación breve acompañada de diversos ejemplos e imágenes que sirven para captar las principales ideas y complementar el tema.
Los ejemplos son una gran herramienta para el entendimiento de los temas ya que vienen de una manera sencilla y clara ademas de que son muy bien explicados todos los pasos que uno debe seguir para entender como cruzar valencias, asignar nomenclaturas y desarrollar todas las actividades planteadas.
Me agrado que los bloques sean muy breves y no sean cargados de información pesada, ya que así es mas fácil la lectura del tema y traen información que ya esta sintetizada y contiene lo mas importante.
En tanto a los ejercicios me parecieron no muy completos y no acompletan bien la información de cada tema ademas de que se me hicieron un tanto fáciles de contestar y creo que no son un buen complemento para practicar lo visto de los distintos temas.
Modelos atómicos
Comprender como el descubrimiento de las partículas subatomicas dieron inicio a los diferentes modelos atómicos.
En este material se muestra la relación que existe entre el descubrimiento de las partículas subátomicas y el proceso a través del cual se han propuesto modelos para ayudar a comprender y explicar los fenómenos y experimentos que se realizaban en la época, así como sus limitaciones. Los modelos son representaciones hipotéticas que nos ayudan a entender el comportamiento de las manifestaciones del entorno que nos rodea. Comprenderás que la ciencia es dinámica y que siempre habrá expresiones de la naturaleza que necesitan interpretarse.
 modelos atómicos
modelos atómicos Antecedentes de los modelos
Hoy en día el conocimiento de la estructura del átomo nos ha permitido identificar y controlar algunos comportamientos de la materia, de tal forma que se han creado nuevos materiales y se han modificado las propiedades de otros. Ejemplos de esto son los súper conductores, los metales más resistentes y ligeros, los nuevos alimentos y medicamentos, materiales biodegradables y textiles. Prácticamente el estudio de la materia impacta en todos los ámbitos de nuestro entorno. A continuación se presentan algunos de los hechos más importantes que antecedieron el desarrollo de los modelos atómicos.
Resultado Ejercicio 1
Modelo de Dalton
Al inicio de la Teoría atómica fue de gran importancia para la ciencia, con ello se pretendía comprender el comportamiento de las sustancias durante los experimentos y así darles una explicación. Dalton es el iniciador de esta revolución científica.
Modelo y postulados:
Primer postulado
Las sustancias se pueden dividir hasta partículas indivisibles y separadas llamadas átomos.
Segundo postulado
Los átomos de un mismo elemento son iguales esencialmente en masa y propiedades, los de otros elementos tienen diferente masa y no se pueden crear o destruir.
En la imagen del lado izquierdo se presentan las marcas arbitrarias o signos que Dalton eligió para representar los diversos elementos químicos. En la imagen del lado derecho están los compuestos que se forman a partir de los elementos.
En la imagen del lado izquierdo se presentan las marcas arbitrarias o signos que Dalton eligió para representar los diversos elementos químicos. En la imagen del lado derecho están los compuestos que se forman a partir de los elementos.
Tercer postulado
Al combinarse dos o más átomos forman un compuesto y la fracción más pequeña de éste es un átomo compuesto, integrado por átomos compuestos idénticos en una relación numérica sencilla de átomos de cada elemento que lo conforma.}
Cuarto postulado
En una reacción química, los átomos se re acomodan para formar nuevos compuestos.
Ejercicio 2
Preguntas de la teoría de Dalton
Modelo de Thompson
Los experimentos que dieron origen a la propuesta del modelo atómico de Thompson se realizaron en 1897 sin embargo, los reportó hasta 1902; en éstos considera al átomo como una gran esfera con carga eléctrica positiva, en la que se distribuyen los electrones como pequeños granitos al que llamó “budín con pasas”, este modelo lo retoma Millikan en 1909 con sus experimentos de “la gota de aceite” en donde logra determinar la carga negativa del electrón.
Partiendo del modelo de Thompson y la identificación de la partícula con carga negativa llamada electrón, fue posible explicar posteriormente cómo se unen los compuestos que hoy se conocen como enlaces, las reacciones de electrolisis con los iones positivos y negativos, entre otras aportaciones; sin embargo, se seguía considerando al átomo continuo pero divisible.

EJERCICIO 3
Crucigrama de la teoría de Thompson
Modelo de Rutherford
Rutherford, basó sus estudios en las partículas alfa, para estudiar su comportamiento colocó en una caja de plomo una muestra de radio y a cierta distancia una pantalla fluorescente y entre ambos una lámina de oro con un grosor de 4 x 10-5 m y observo lo siguiente:
La mayoría de las partículas alfa atraviesan la lámina de oro sin sufrir ninguna desviación, entonces debía haber espacios vacíos entre los átomos de oro.
Una de cada 40,000 partículas alfa se desvían en un ángulo mayor de 90° en la lámina de oro, esto implicaba la existencia de un núcleo con carga positiva que provoca esta desviación.
Una de cada 40,000 partículas alfa rebotaban en la lámina de oro, esto implicaba la existencia de un núcleo con carga positiva.
Con estas conclusiones propone su modelo atómico que consiste en:
El centro del átomo está constituido por el núcleo donde reside su masa con carga positiva, a la que llamo proton, y una atmósfera electrónica compuesta de órbitas indeterminadas en las que se encuentran los electrones en el sistema planetario, por lo que debe haber espacio vacío; sin embargo, se tenían algunas dudas sobre este modelo y fue hasta 1920 que James Chadwik , con experimentos semejantes a los de Rutherford lo confirma y además descubre una partícula atómica con una masa igual a la del protón y sin carga a la que llamo neutrón . A continuación te mostramos una animación para que observes el experimento que realizó Rutherford.
Rutherford suponía que si el electrón está cargado eléctrica mente y se encuentra en movimiento constantemente, utilizara energía, lo que provocaría que ésta disminuya gradualmente hasta agotarla y entonces el electrón caería hacia el núcleo destruyendo el átomo, sin embargo, su hipótesis no pudo ser demostrada.









Bien, espero que la realización de los ejercicios te sirva para confirmar tus aprendizajes
ResponderEliminar