El enlace ionico se produce por la transferencia de electrones entre un metal, capaz de ceder electrones, y un no metal, capaz de captarlas, es decir entre atomos con electronegatividad muy diferentes.
Las fuerzas de atraccion electroestatica entre iones de diferente signo dan lugar al enlace ionico. Se denomina electrovalencia o valencia ionica, al numero de electrones intercambiados por cada eleemento en un enlace ionico.
Dado que los elementos implicados tienen elevadas diferencias de electronegatividad, este enlace suele darse entre un compuesto metalico y uno no metalico. Se produce una transferencia electrónica total de un átomo a otro formándose iones de diferente signo. El metal dona uno o más electrones formando iones con carga positiva o cationes con una configuración electronica estable. Estos electrones luego ingresan en el no metal, originando un ion cargado negativamente o anión, que también tiene configuración electrónica estable. Son estables pues ambos, según la regla del octeto o por la estructura de Lewis adquieren 8 electrones en su capa más exterior (capa de valencia), aunque esto no es del todo cierto ya que contamos con varias excepciones, la del hidrogeno (H) que se llega al octeto con 2 electrones, el berilio (Be) con 4 ,el alumino (Al) y el boro (B) que se rodean de seis.
Ejemplo:
Formacion de Cloruro de Sodio

Caracteristicas y propiedades del enlace ionico:
- Ruptura de nucleo masivo
- Son enlaces muy fuertes
- Son solidos de estructura cristalina en el sistema cubico
- Altos puntos de fusion (entre 300° y 1000°C de ebullición)
- Son enlaces resultantes de la interacción entre los metales de los grupos I y II y los no metales de los gruposVI y VII
- Son solubles en agua y otras disoluciones acuosas
- Una vez en soluciones acuosas son conductores de electricidad
- En estado solido no conduce electricidad
Anión- Es un ion con carga electrica negativa, lo que significa que los átomos que lo conforman tienen un exceso de electrones. Comúnmente los aniones están formados por no metales, aunque hay ciertos aniones formados por metales y no metales.
Catión-Es un ion con carga eléctrica positiva. Los más comunes se forman a partir de metales.
Video en el que se explica la formación de un enlace ionico
El video habla de como se origina el enlace ionico adem'as de exolicar de una manera clara como se lleva acabo la union de dos atomos para la formacion de un enlace ionico, menciona caracteristicas y propiedades que identifican a este enlace.
Redes Cristalinas
La red cristalina
está formada por iones de signo opuesto, de manera que cada uno crea a su
alrededor un campo eléctrico que posibilita que estén rodeados de iones contrarios.
Los sólidos cristalinos
mantienen sus iones prácticamente en contacto mutuo, lo que explica que sean
prácticamente incompresibles. Además, estos iones no pueden moverse libremente,
sino que se hallan dispuestos en posiciones fijas distribuídas desordenadamente
en el espacio formando retículos cristalinos o redes espaciales. Los cristalógrafos
clasifican los retículos cristalinos en siete tipos de poliedros llama sistemas
cristalográficos. En cada uno de ellos los iones pueden ocupar los vértices,
los centros de las caras o el centro del cuerpo de dichos poliedros. El más sencillo
de éstos recibe el nombre de celdilla unidad.
Uno de los parámetros
básicos de todo cristal es el llamado índice de coordinación que podemos
definir como el número de iones de un signo que rodean a un ion de signo
opuesto. Podrán existir, según los casos, índices diferentes para el catión y
para el anión.
El índice de coordinación, así como el tipo
de estructura geométrica en que cristalice un compuesto iónico dependen de dos
factores:
• Tamaño de los iones. El valor del radio de los iones marcará las
distancias de equilibrio a que éstos se situarán entre sí por simple cuestión
de cabida eni espacio de la red.
• Carga de los iones. Se agruparán los iones en la red de forma que se
mantenga la electroneutralidad del cristal.
Podemos agrupar la mayor partede los compuestos ionicos en una serie de estructuras:
|
Red
|
Índice de coordinación |
Compuesto
|
|
Cúbica centrada en el cuerpo
|
8
|
CsCl, CsBr, Csl
|
|
Cúbica centrada en las caras
|
6
|
NaCl, NaBr, Nal, MgO, CaO
|
|
Tetraédrica
|
4
|
ZnS, BeO, BeS
|
|
Tipo fluorita
|
Catión = 8
Anión = 4 |
CaF2, SrF2, BaCl2
|
|
Tipo rutilo
|
Catión = 6
Anión = 3 |
TiO2, SnO2, PbO2
|
Ejemplos de redes cristalinas:
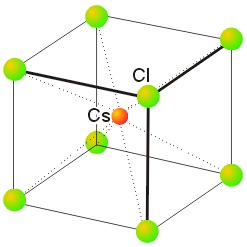 |
| Red de Cloruro de Cesio |

Video explicacion de la estructura y definicion de redes cristalinas
Solvatacion
La solvatación es un proceso que consiste en la atracción y agrupación de las moléculas que conforman un disolvente, o en el caso del soluto, sus iones. Cuando se disuelven los iones de un disolvente, éstos se separan y se rodean de las moléculas que forman el disolvente. Cuanto mayor es el tamaño del ion, mayor será el número de moléculas capaces de rodear a éste, por lo que se dice que el ion se encuentra mayormente solvatado.
Según la IUPAC, (Unión Internacional de Química Pura y Aplicada), la estabilización de las especies que forman un soluto en una solución, viene dada por la interacción de un soluto con un disolvente. También, cuando un ion se encuentra formado por un átomo central y rodeado por moléculas, se dice que está solvatado, a este tipo de ion se le llama complejo. La solvatación, también puede darse en un material que sea insoluble.
La entalpía de solvatación, puede dar respuesta al porqué la solvatación tiene lugar con algunas redes iónicas sí, y con otras, en cambio, no, pues un valor negativo de entalpía de solución, corresponde a un ion que se acabará disolviendo, pero sin embargo, un valor positivo, llega como significado que la solvatación no será fácil.
Por mucho tiempo se pensó, que la densidad de carga, o lo que es lo mismo, la relación entre la carga el tamaño del ion, proporcionaban una mayor solvatación, pero hoy en día, se sabe que este dato no es correcto, pues no resulta aplicable a todos los iones, como por ejemplo a los iones de hierro (III), a los grupos de lactánidos y Actídidos.
Ejemplos de solvatacion
Buena tu investigación sobre enlace iónico, solo falto hablar del enlace covalente.
ResponderEliminarRecuerda SIEMPRE ANOTAR LAS REFERENCIAS
CALIFICACION FINAL DEL BLOG 9
ResponderEliminarFelicidades!!